理化学研究所(理研)生命医科学研究センター 細胞機能変換技術研究チームの秦 咸陽 研究員、鈴木 治和 チームリーダー、高エネルギー加速器研究機構(KEK)物質構造科学研究所の清水 伸隆 教授らの国際共同研究グループは、世界初の肝がん再発予防薬として期待される「非環式レチノイド[1](一般名:ペレチノイン)」がタンパク質架橋酵素トランスグルタミナーゼ(TG2)[2]に結合することを発見しました。
本研究成果は、肝がん治療後の再発を予防する補助療法の開発やタンパク質架橋酵素の活性制御のために、非環式レチノイドを構造基盤とした創薬研究に貢献すると期待できます。
これまで非環式レチノイドの作用には異常細胞の増殖シグナルを抑制することなどが知られていましたが、実際にその作用に非環式レチノイドがどのように関わっているのか、特にどのタンパク質と結合するのかは明らかではありませんでした。
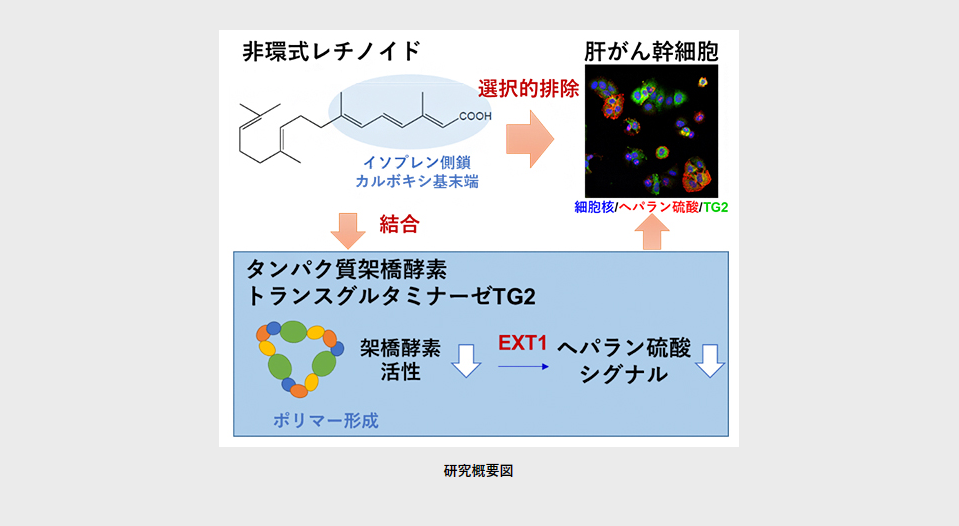
今回、国際共同研究グループは非環式レチノイドのイソプレン側鎖とカルボキシ基末端がTG2と結合することで、TG2の立体構造を変化させ、そのタンパク質架橋酵素活性を阻害することを明らかにしました。さらにTG2阻害剤が肝がん細胞の幹細胞化と細胞増殖を特異的に阻害することを見いだし、TG2の分子標的としてヘパラン硫酸シグナル経路[3]を同定しました。
本研究は、科学雑誌『Cell Death & Disease』オンライン版(6月13日付:日本時間6月13日)に掲載されます。
背景
2020年に世界全体の肝がん死亡者数は83万人を超え、過去20年間で約2倍に増加しています注1)。肝がんの年間発症者数と死亡者数の比率はほぼ1対1となっており、極めて予後の悪いがんの一つです。その原因は、肝がんの根治治療後の再発率が80%に上るにもかかわらず、肝がん治療後の再発を予防する補助療法がいまだに確立されていないことが挙げられます。
非環式レチノイドは、1981年に岐阜大学の武藤泰敏教授(当時)が発表した環状構造を持たない脂溶性ビタミンA類縁体で、正常肝細胞には影響せず、肝がん細胞・幹細胞に対して選択的に異常増殖を抑制し、世界初の肝がん再発予防薬として期待されています注2、3)。
その作用機序として、レチノイン酸受容体RXRαが過剰にリン酸化される反応を抑制して、RXRαの転写因子[4]活性を正常化することのほかに、細胞核に局在するトランスグルタミナーゼ(TG2)というタンパク質を介する転写因子Sp1の架橋を不活性化することで、異常細胞の増殖シグナルを抑制する作用が知られています。しかし、この作用に非環式レチノイドがどのように関わっているのか、特にどのタンパク質と結合するのかは明らかではありませんでした。
注1)Sung H, Ferlay J, Siegel R, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3):209-49. doi: 10.3322/caac.21660
注2)2016年1月8日プレスリリース「肝がん再発予防薬の作用メカニズムを解明」
注3)2018年4月24日プレスリリース「非環式レチノイドによるMYCN陽性肝がん幹細胞の排除」
研究手法と成果
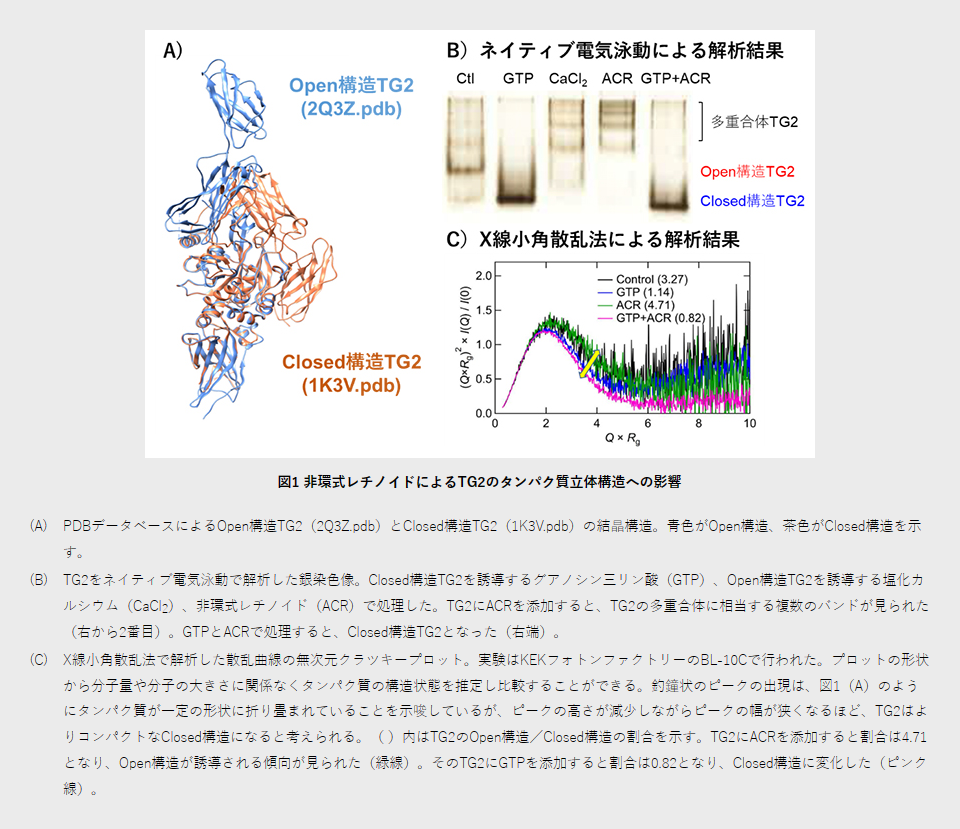
国際共同研究グループは、これまでに非環式レチノイドの活性部位がイソプレン側鎖とカルボキシ基末端(-COOH)であることを同定していました。そこで、この構造の反対側末端を磁性ビーズ「FGビーズ[5]」に固定させ、直接結合するタンパク質を探索しました。その結果、非環式レチノイドが濃度依存的にタンパク質架橋酵素TG2と結合することが分かりました。TG2の立体構造にはOpen構造とClosed構造の二つがあり、立体構造を変化させることでTG2は多彩な機能を発揮します(図1A)。
次に、ネイティブ電気泳動[6]とX線小角散乱法(SAXS法)[7]を用いて、非環式レチノイドによって溶液中のTG2の立体構造がどのように変化するのかを調べました。ネイティブ電気泳動では、非環式レチノイドを添加するとTG2の多重合体(200~350kDa)に相当する複数のバンドが観測されました(図1BのACR)。さらに、タンパク質構造データバンク(PDB)[8]に登録されているTG2の二つの結晶構造を基に、SAXS法で得られた散乱曲線に対してOpen構造/Closed構造の割合を計算しました。すると、非環式レチノイドを添加することにより、タンパク質架橋酵素活性を持つOpen構造のTG2が誘導される傾向が見られました。非環式レチノイドとグアノシン三リン酸(GTP)を添加すると、GTP加水分解酵素(GTPase)[9]活性を持つClosed構造のTG2に変化しました(図1C)。
これらの結果は、非環式レチノイドのイソプレン側鎖とカルボキシ基末端がTG2と直接結合し、そのタンパク質の立体構造を変化させることを示しています。
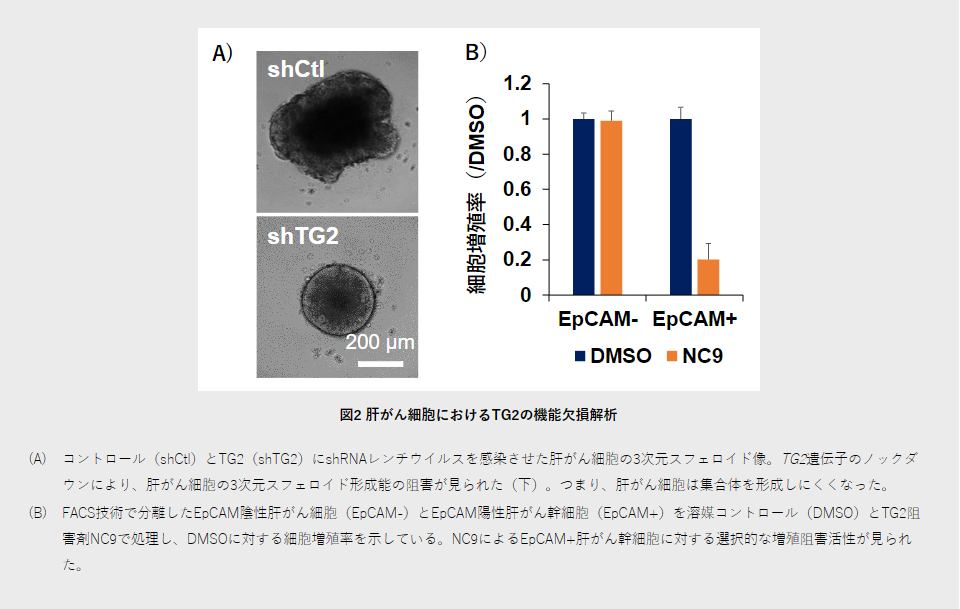
次に、非環式レチノイドはTG2重合体の形成を誘導することで、TG2のタンパク質架橋酵素活性を阻害することを見いだしました。そこで、TG2の機能を一部欠損させて、肝がん細胞の幹細胞化と細胞増殖にどのように影響するかを調べました。TG2遺伝子をノックダウン[10]すると、肝がん細胞増殖の抑制とともに、幹細胞化の指標となるマーカー遺伝子EpCAMやMYCNの発現や3次元スフェロイド[11]形成能の阻害が観察されました(図2A)。
さらに、蛍光活性化セルソーティング(FACS)技術[12]を用いて、単離されたEpCAM陽性肝がん幹細胞を調べた結果、TG2遺伝子とTG2タンパク質の高い発現が見られました。また、TG2阻害剤NC9はEpCAM陽性肝がん幹細胞に対して特異的に細胞死を誘導することが分かりました(図2B)。以上の結果から、TG2は肝がん細胞・幹細胞を標的とする新たな肝がん治療/予防の標的であることを発見しました。
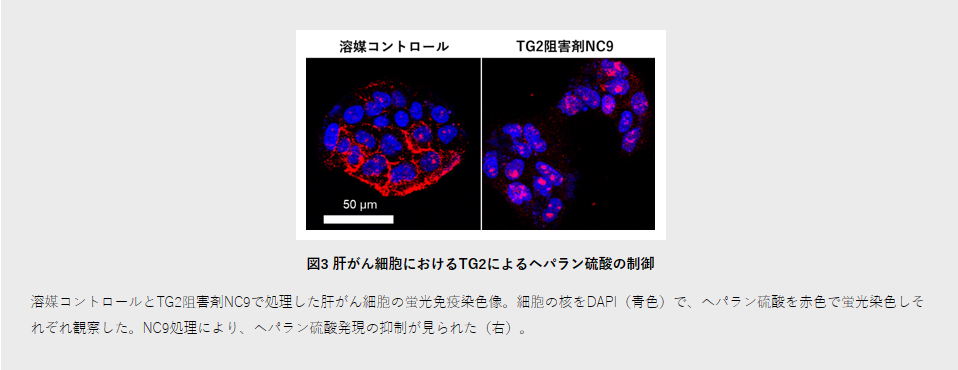
最後に、肝がん細胞においてTG2の標的分子を探索しました。プロテオーム解析[13]では、がんの発生と進行に関わるヘパラン硫酸プロテオグリカン[14]の合成酵素EXT1がTG2遺伝子の下流で制御されることが分かりました。siRNA[15]を用いた機能欠損解析では、EXT1ノックダウンにより肝がん細胞株の増殖が抑制されました。さらに、ヘパラン硫酸に対する免疫染色法[16]により、EpCAM陽性肝がん幹細胞ではヘパラン硫酸が高く発現し、TG2との強い共発現が見られました。さらにTG2阻害剤NC9を添加することにより、肝がん細胞のヘパラン硫酸の発現が強く抑制されました(図3)。この結果は、TG2がヘパラン硫酸シグナルを介して肝がん幹細胞増殖を制御する可能性を示しています。
今後の期待
本研究では、非環式レチノイドによる肝がん幹細胞の選択的排除において、TG2の立体構造に依存したタンパク質架橋酵素活性の制御、ならびにTG2の分子標的がヘパラン硫酸シグナルであることを明らかにしました。特に、非環式レチノイドのイソプレン側鎖とカルボキシ基末端構造がTG2と結合することがTG2の立体構造の制御に重要であると判明しました。
本成果は今後、TG2の非環式レチノイドとの結合部位やヘパラン硫酸の結合タンパク質を特定することで、非環式レチノイドを構造基盤とした肝がん再発予防を含めたさまざまな創薬研究の足掛かりになると期待できます。

アドレス:東京都荒川区南千住3丁目27-2浅草ビル508

電話番号:011-25154851

ファクシミリ:010-25251648

メールボックス:kuokaservice@gmail.com