理化学研究所(理研)生命医科学研究センター 免疫器官形成研究チームの古関 明彦 チームリーダー(千葉大学 大学院医学研究院 細胞分子医学 教授)、千葉大学 大学院医学薬学府の高野 淳一朗 大学院生(研究当時、現理研 免疫器官形成研究チーム特別研究員)、東京理科大学 生命医科学研究所免疫アレルギー部門の伊川 友活 教授らの国際共同研究グループは、エピジェネティクス[1]制御因子のポリコム抑制性複合体(PRC)[2]の一つであるPCGF1[3]-PRC1が、DNA複製フォーク[4]の近くで転写活性化因子[5]の接近を阻害することで、新生DNA鎖上のクロマチン[6]環境を整え、造血前駆細胞[7]の分化能を維持していることを発見しました。
本研究成果は、細胞増殖と細胞分化の関連についての理解を深め、細胞運命制御機構の解明、ならびに造血器腫瘍発症機序の理解につながると期待できます。
従来、クロマチンの状態が遺伝子の発現状態および細胞運命を決定するため、増殖中の細胞がその特性を維持するには、分裂時にクロマチン構造が的確に継承される必要があると考えられてきましたが、そのメカニズムは未解明でした。
今回、国際共同研究グループは、PCGF1-PRC1の構成要素であるPCGF1を欠損させた造血システムの動態、ならびに造血前駆細胞の新生DNA鎖上のクロマチン環境を解析し、PCGF1-PRC1がクロマチン継承を介した分化能維持に重要であることを示しました。
本研究は、オンライン科学雑誌『Nature Communications』(11月28日付)に掲載されました。
背景
およそ70年前、「分裂して生じる二つの娘細胞は同等ではなく、特定の遺伝子の活性化に違いがあり、この違いの要因は遺伝子を覆うクロマチンにある。すなわち、覆われていた遺伝子が露出したときのみ活性化が起こる」という概念が提唱されました。以来、細胞分裂時に娘細胞に継承されるクロマチンの状態が遺伝子の発現状態、ひいては細胞運命を決定すると広く考えられてきました。
初期造血において、造血前駆細胞は細胞分裂を続ける過程で次第に個性を獲得し、異なる系統へ分化していきます。その際、DNA複製時に複製フォーク(二本鎖DNAが解離した領域)が通過するとクロマチン構造は崩壊し、直ちに新生DNA鎖上に再構築されますが、造血前駆細胞の分化能を保持するには、新生DNA鎖上へのクロマチンが的確に継承される必要があります。しかし、その機構は不明でした。
ポリコム抑制性複合体(PRC)はヒストン修飾を介して遺伝子発現を規定し、細胞特性の維持に寄与するエピジェネティクス制御因子です。ヒストンH2Aの119番目のリジン残基(H2AK119)のモノユビキチン化(H2AK119ub1)を担うPRC1、ヒストンH3の27番目のリジン残基(H3K27)のメチル化(H3K27me3)を行うPRC2の二つの複合体が協調し、標的発生関連遺伝子の発現を抑制することで機能します。PRC1には六つの亜型があり、PCGF1を含む異性型PRC1(PCGF1-PRC1)は比較的新しく同定されたものです。
血球系細胞の細胞運命を維持するには、PRC1に形成される抑制状態が必須です。また、これまでにDNA複製期におけるPRC1の複製フォーク近くへの局在が報告されていましたが、複製フォーク上でのPRC1の機能は不明でした。
以上から、国際共同研究グループはPRC1が複製フォーク近くで、新生DNA鎖上への的確なクロマチン構造の継承ならびに細胞運命決定に重要な役割を担うのではないかと考えました。
研究手法と成果
国際共同研究グループは、まず新生DNA鎖上のタンパク質を抽出するiPOND法[8]とプロテオーム解析[9]を組み合わせた手法により、造血前駆細胞においてPCGF1-PRC1が複製フォーク近くに局在していることを見いだしました。
そして、PCGF1を欠損させると、BRG1をはじめとした転写活性化に関わるクロマチンリモデリング因子[10]が新生DNA上に過剰蓄積することを発見しました。この結果、新生DNA鎖上のクロマチン構造が不安定化し、PCGF1の結合したミエロイド系[11]遺伝子座におけるヌクレオソーム(ヒストン八量体をDNAが取り巻いたクロマチンの基本単位)の密度が低下することを、MNase-Seq法[12]とiPOND法を組み合わせた解析により示しました(図1の青線→黒線)。
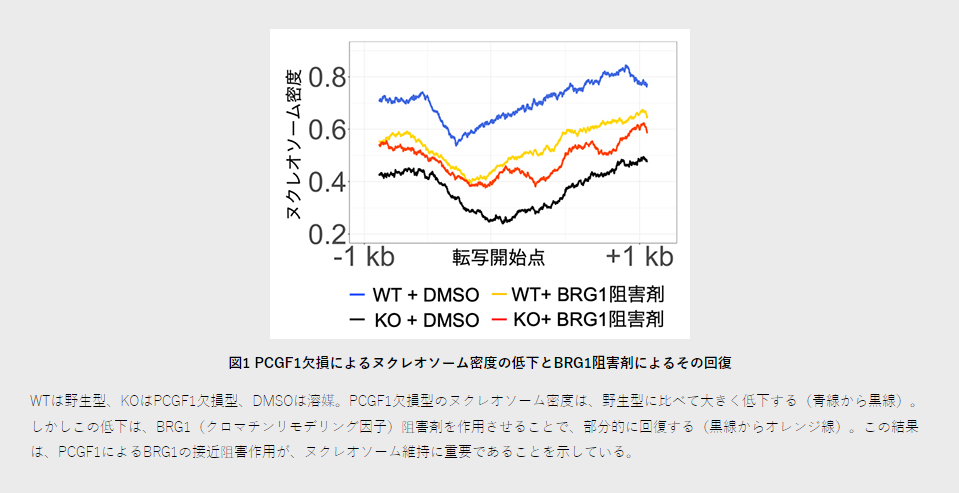
ヌクレオソーム密度は、PRC2によるH3K27me3修飾を介した遺伝子発現抑制に重要ですが、クロマチン免疫沈降法[13]を用いて解析したところ、ヌクレオソーム密度低下の結果、PCGF1欠損下ではH3K27me3を介したミエロイド系遺伝子の発現抑制が破綻していることが分かりました。
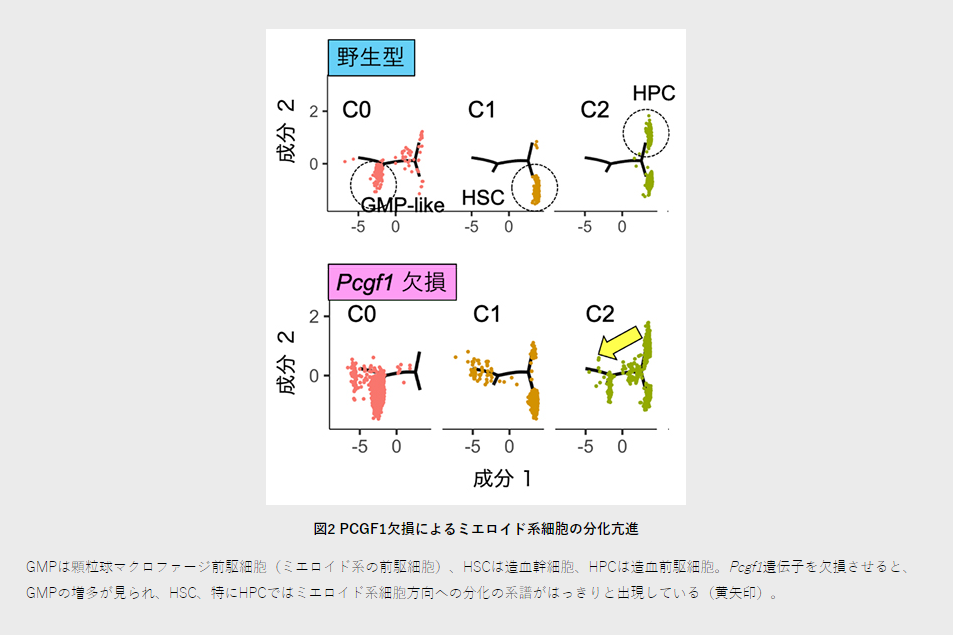
一方、PCGF1欠損に伴なうミエロイド系遺伝子の異常発現により、in vivo(生体内)でミエロイド系細胞の分化が亢進することを、一細胞RNAシーケンス法[14]を用いて、一細胞レベルで証明しました(図2)。
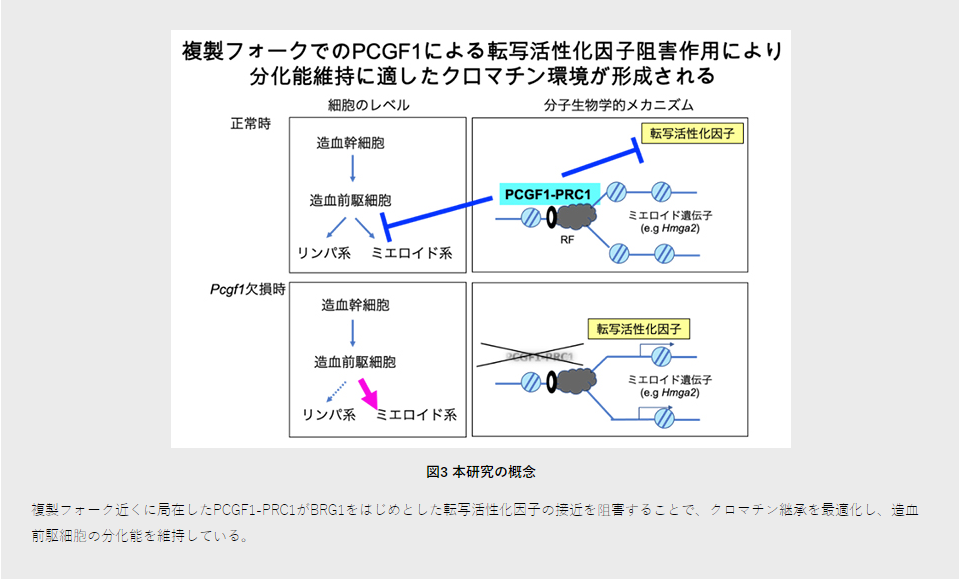
さらに、PCGF1-PRC1標的遺伝子の一つで、上述したメカニズムで抑制されるミエロイド系遺伝子をノックダウン[15]したところ、造血前駆細胞の分化異常が部分的に回復しました。従って、PCGF1-PRC1はDNA複製期に、クロマチン環境を最適化することで、ミエロイド系遺伝子の発現およびミエロイド系分化の亢進を制御する可能性が示されました(図3)。
今後の期待
本研究では、これまで未知であった複製フォーク近くでのPRC1の機能を明らかにするとともに、クロマチン継承が細胞運命決定において担う重要な役割の具体例を提唱しました。
DNA複製に関連したプロセスの異常が悪性疾患の発症につながることを考えると、DNA複製におけるPCGF1-PRC1の機能の理解は、エピジェネティクス研究の新しい視座を切り拓く可能性があるのみでなく、悪性腫瘍の成因の理解、治療戦略の開発にも貢献すると考えられます。実際、PCGF1-PRC1は造血器腫瘍の分野においても注目を集めており、例えば、骨髄異形成症候群においては、PCGF1-PRC1の構成要素の一つであるBcor遺伝子の機能喪失性の変異が一定頻度で見られます。したがって、フォーク上のPCGF1-PRC1の機能を明確にすることは、疾患の成因の解明および治療法の開発につながる可能性があリます。

アドレス:東京都荒川区南千住3丁目27-2浅草ビル508

電話番号:011-25154851

ファクシミリ:010-25251648

メールボックス:kuokaservice@gmail.com